Несмотря на свое название, кислотоустойчивые бактерии предпочитают расти на нейтральных средах. Их устойчивость к перепадам кислотности внешней среды обусловлена особым строением клеточной стенки и составом клеточного содержимого.
Общие сведения о методе
Препараты микробов подвергают действию химических реагентов, обычно — красителей, или тетраоксида осмия. В результате физико-химического процесса взаимодействия красителя с химическими соединениями объектов, с целью искусственного придания ему определённой окраски, появляется возможность определить вид микроорганизма, или хотя бы тип его мембраны (см. окраска по Граму).
Способы крашения разделяют на витальный, поствитальный и негативный, последний может быть витальным и поствитальным.
Витальный способ окраски
Для витального (прижизненного) крашения применяют 0,2-0,001 % водные растворы метиленового и толуоидинового синего, нейтральрот и конго красный, которые добавляют в придавленную или висячую капли культуры. Этим способом выявляют спирохеты, простейшие, определяют подвижность бактерий, иммунное набухание капсулы, но использование его требует строгого соблюдения правил, исключающих лабораторное заражение.
Поствитальные способы окраски
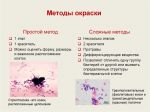
Способы окраски фиксированных препаратов (поствитальные) разделяют на простые и сложные. При простых способах красящие растворы фуксина Пфейффера (экспозиция 1-2 мин), щелочного метиленового синего (3-5 мин) наносят на фиксированный препарат, так, чтобы он полностью покрыл мазок, краситель сливают, препарат промывают струйкой воды, встряхивают, высушивают и микроскопируют. Простые способы позволяют судить о величине, форме, локализации, взаимном расположении отдельных клеток, но с их помощью нельзя установить структуру микробов и часто их дифференцированное отношение к красителям. Из сложных способов окрашивания бактерий в основном используют дифференцированный способ Грама, выявление кислотоустойчивости по Цилю — Нельсену, определение волютиновых зёрен по Леффлеру или Нейссеру, дифференцирующий способ Романовского — Гимзы, негативно-позитивный способ определения капсулы по Гинсу — Бурри, выявление спор по Пешкову или Цилю — Нельсону и др. Для окраски простейших применяют способ Романовского — Гимзы и окраску гематоксилин-эозином. Грибы исследуют неокрашенными или способами Грама, Циля — Нельсона, Леффлера, Романовского — Гимзы, а также раствором Люголя, лактофуксином и др.
- Морфология микроорганизмов. Методы …
- Морфология микроорганизмов. Методы …
- Микроскопия Сложные методы окраски …
- Морфология микроорганизмов. Методы …
Исследование микроорганизмов в живом состоянии
Так как методы обнаружения жгутиков трудны, а определение подвижности микробов служит целям определения их вида, то в повседневной лабораторной практике для определения подвижности пользуются наблюдением бактерий в живом состоянии — в раздавленной или висячей капле. Раздавленная капля. На середину предметного стекла наносят петлей или пипеткой каплю исследуемого материала. Эту каплю накрывают покровным стеклом, осторожно накладывая его пинцетом, чтобы в жидкости не образовалось пузырьков воздуха. Правильно сделанная капля заполняет все пространство между покровным и предметным стеклом, но при этом жидкость не выступает за края покровного стекла. Если требуется рассматривать препарат продолжительное время, то края покровного стекла предварительно смазывают вазелином. Висячая капля. Каплю исследуемого материала наносят на середину покровного стекла. Затем покровное стекло быстро поворачивают каплей вниз и накладывают на предметное стекло с углублением («лункой») в середине. Капля должна свободно свисать в углубление, не соприкасаясь с его дном и краями (рис. 20). Края выемки на предметном стекле следует предварительно смазать вазелином. Таким образом, капля оказывается герметически закрытой во влажной камере и защищенной от высыхания. Определение подвижности у микробов используется при лабораторной диагностике дизентерии, холеры, брюшного тифа и других заболеваний. При исследовании живых микробов следует отличать активную подвижность бактерий, свидетельствующую о наличии у них невидимых жгутиков, от пассивного молекулярного (броуновского) движения, свойственного всем взвешенным в жидкости мелким частицам (форменные элементы, зернышки, пылинки, микробы как лишенные жгутиков, так и убитые).
Рис. 20. Висячая капля.
Исследование в темном поле зрения. Движение бактерий и спирохет можно наблюдать в микроскопе, который отличается от обычного применением яркого бокового освещения, в силу чего получается изображение светящегося объекта на темном фоне. Принцип темного поля основан на том, что падающие сбоку световые лучи отклоняются плотными частицами (в частности, бактериями) и последние благодаря этому представляются глазу наблюдателя ярко светящимися. Боковое освещение в микроскопе можно получить, заменив обычный осветитель специальным конденсором с затемнением в центре. Такой конденсор задерживает все центральные лучи света и пропускает лишь периферические. Техника исследования заключается в следующем. На предметное стекло наносят каплю исследуемого материала и осторожно накрывают покровным стеклом, чтобы не было пузырьков воздуха. Затем на поверхность конденсора помещают каплю воды или кедрового масла и предметное стекло с препаратом кладут на эту каплю.
- Назад
- Вперёд
Рекомендуемые статьи
В лабораторной диагностике применяют простые и сложные методы окраски. С какой целью применяют простые методы окраски?
Простые и сложные методы окраски. метод грама
Простые и сложные методы окраски
Простые и сложные способы окраски микроорганизмов. Способы окраски спор, жгутиков, капсул, включений
- Морфология микроорганизмов. Методы …
- Экзаменационные микропрепараты …
- Морфология микроорганизмов. Методы …
- Микроскопия Сложные методы окраски …
Простые и сложные методы окраски микробов
Простые и сложные методы окраски бактерий. Способы окраски спор, жгутиков, капсул, включений. Окраска по Граму
Простые и сложные методы окраски микробов
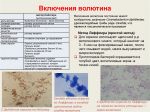
Кислотоустойчивость и строение клетки
Наиболее часто бактерии, обладающие кислотоустойчивостью, микробиология описывает среди микобактерий и актиномицетов. Это связано с особенностью строения их клеточной стенки, содержащей миколовые кислоты, небольшое количество липидов, тейхоевых кислот, полисахаридов и полипептидов, а также воска. Используя методы выявления кислотоустойчивости, микробиологи узнали много нового о строении бактериальных спор и клеточной стенки.
Обнаружено сходство клеточных стенок кислотоустойчивых бактерий и бактериальных спор, обуславливающее их свойства.
Подготовка материала
По правилам микробиологии, окраска по Граму требует предварительной подготовки материалов. Его необходимо распределить тонким слоем по поверхности стекла. Затем мазок подсушивают и после полного высыхания фиксируют. При этом мазок закрепляется на стекле, что позволяет исключить смывание бактерий красителями. К тому же мертвые микроорганизмы окрашиваются лучше, чем живые.
После подготовки материала подбирают метод окрашивания: физический или химический. Первый предполагает воздействие высокой температуры на микробную клетку. Во время химического способа применяют различные химические вещества, которые вызывают коагуляцию протеинов цитоплазмы.
Подготавливают набор для окраски по Граму, предметные стекла с бактериями. Их берут пинцетом или аккуратно пальцами за ребра мазком вверх, затем проводят пару раз над верхом пламени горелки. Процесс должен занимать пару секунд.
Процесс фиксации химическим методом предполагает использование ацетона, спирта, специальных смесей, жидкость Карнуа. Предметное стекло с высушенным мазком погружают в фиксирующее вещество на пятнадцать минут, затем просушивают на воздухе.
Окрашивание
Окраска мазков по Граму проводится по определенному алгоритму.
Чтобы определить, есть ли в мазке грамотрицательные бактерии, проводят дополнительно окрашивание фуксином или сафранином. Препараты наносят на две минуты. В конце процедуры стекло промывают, высушивают.
Результаты
Все грамположительные микроорганизмы окрашиваются в темно-фиолетовый цвет, а грамотрицательные – в красный. Шарообразные формы обычно относятся к грамположительным видам, а извитые формы – отрицательно окрашиваются. Палочковидные бактерии могут быть грамотрицательными и грамположительными.
Чтобы получить максимально достоверные результаты исследований, рекомендуется применять суточные культуры, а также свежеприготовленные растворы для окрашивания.
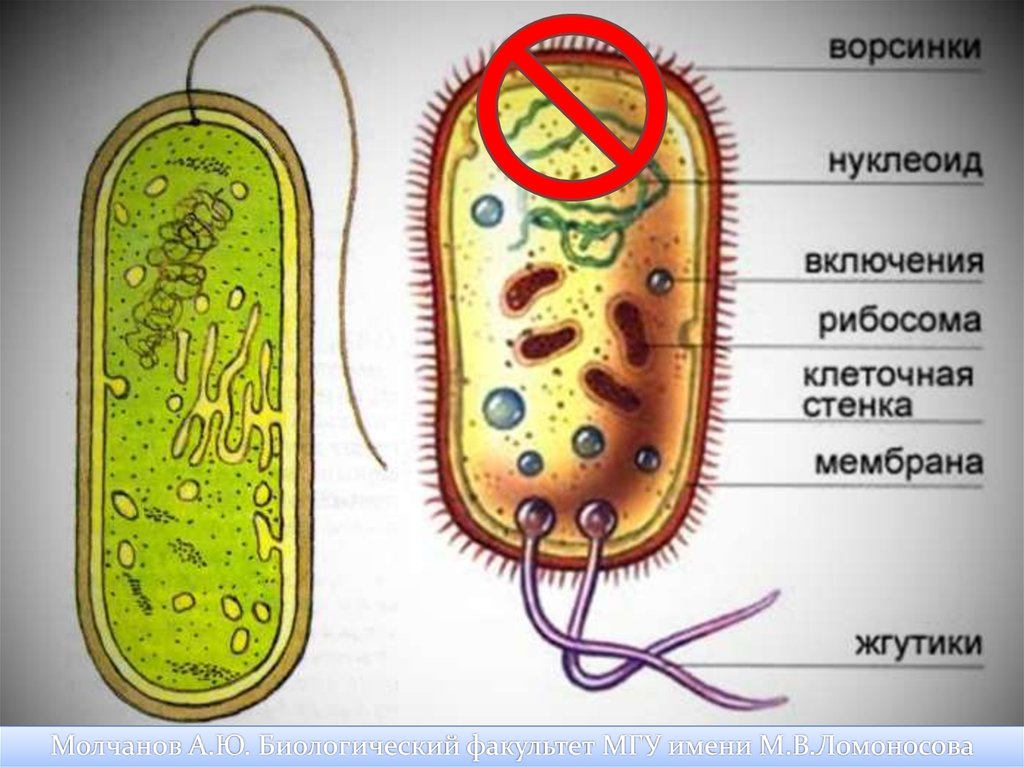
Механизм окраски позволяет увидеть и оценить физико-химические особенности строения цитоплазмы, клеточные стенки грамположительных и грамотрицательных бактерий. У первых содержится много рибонуклеиновой кислоты, белков в цитоплазме, а в клеточных стенках – пептидогликана. Из-за этого во время обработки мазков генцианвиолетом и Люголем у грамположительных видов бактерий образуется прочное соединение ионов йода и красителя.
При обработке спиртами грамположительные микроорганизмы удерживают краситель, а грамотрицательные – обесцвечиваются и окрашиваются дополнительно разведенным фуксином в красный оттенок. Некоторые бактерии способны окрашиваться только на стадии роста.
Применение
Окраску по Граму проводят при анализе вида микроорганизмов в мазках из влагалища и слюны. Этот способ позволяет определить вид микроорганизмов в кале, в плевральной, перитонеальной жидкости и не только. Любые жидкости, где могут содержаться бактерии, исследуют данным методом. После проведения окрашивания врачи подбирают метод лечения, назначая препараты, способные воздействовать на грамположительные или грамотрицательные бактерии.